Thủ tục
Dưới kính hiển vi sử dụng giao diện phần mềm, phần mô (dày 5-50 micromet) được xem và các tế bào riêng lẻ hoặc các cụm tế bào được xác định bằng tay hoặc bằng các phương pháp tự động bán tự động hoặc bán tự động cho phép tạo hình ảnh và sau đó tự động lựa chọn mục tiêu để cô lập. Hiện nay có sáu công nghệ thu gom / thu gom sơ cấp sử dụng kính hiển vi và thiết bị để phân lập tế bào. Bốn trong số này thường sử dụng tia cực tím (355 nm) để cắt trực tiếp các mô hoặc các màng / màng, và đôi khi kết hợp với một laser hồng ngoại chịu trách nhiệm cho việc sưởi ấm / tan chảy một polyme dính cho sự kết dính và cô lập của tế bào. IR laser cung cấp một cách tiếp cận nhẹ nhàng hơn để microdissection. Công nghệ laser tia cực tím thứ năm sử dụng các tấm trượt đặc biệt phủ một lớp phủ truyền năng lượng, khi được kích hoạt bởi xung laser, đẩy mô hoặc tế bào vào nắp thu.
Chiều rộng cắt laser thường nhỏ hơn 1 μm, do đó các tế bào mục tiêu không bị ảnh hưởng bởi chùm laser. Ngay cả các tế bào sống không bị hư hỏng do cắt laze và có khả năng sống sót sau khi cắt để nhân bản và tái tạo lại nếu thích hợp.
Các công nghệ khác nhau khác nhau trong quy trình thu thập, các phương pháp hình ảnh có thể (kính hiển vi huỳnh quang / kính hiển vi trường sáng / kính phân cực tương phản chéo / kính hiển vi tương phản pha / vv) và các loại đầu cắm và chuẩn bị mô cần thiết trước khi chụp ảnh và cách ly. Hầu hết các hệ thống này đều là các hệ thống phân tích vi mô chủ yếu, và một số có thể được sử dụng làm kính hiển vi nghiên cứu, chỉ có một công nghệ (số 2 ở đây, Leica) sử dụng kính hiển vi thẳng đứng, hạn chế một số khả năng xử lý mẫu, đặc biệt là đối với các tế bào sống.
Công nghệ đầu tiên (được Carl Zeiss PALM sử dụng) cắt xung quanh mẫu và thu thập nó bằng công nghệ “catapulting”. Mẫu này có thể được phóng ra từ đĩa trượt hoặc đĩa nuôi đặc biệt bằng một xung laser U.V không định hướng, tạo ra một lực lượng photonic để đẩy vật liệu ra khỏi đĩa trượt / kỹ thuật, một kỹ thuật đôi khi được gọi là LMPC (Laser Micro-dissection Pressure Catapulting). Vật liệu đã được chải sẽ được đưa lên tới một cái nắp ống nhỏ vi vi ba hoặc một bộ thu khác có chứa chất đệm hoặc vật liệu dính đặc biệt trong nắp ống mà mô sẽ dính vào. Quá trình phóng tác động này tránh một số vấn đề tĩnh khi sử dụng các màng tráng phủ màng.
Một quá trình khác theo phương pháp microdissection hỗ trợ lực hấp dẫn để thu thập mẫu trong nắp ống dưới slide được sử dụng (được sử dụng bởi hệ thống ION LMD, Jungwoo F & B). Trong trường hợp của hệ thống này, nó di chuyển giai đoạn động cơ để cắt các tế bào lợi ích, giữ chùm laser cố định. Và hệ thống này sử dụng tia laser Solid-state 355 nm (UV-A), đây là cách an toàn nhất để cắt các mô mà không có RNA hoặc DNA bị hư hại.
Một quá trình LCM khác có liên quan chặt chẽ (được sử dụng bởi Leica) đã cắt mẫu từ trên xuống và các mẫu rơi qua trọng lực (kính hiển vi hỗ trợ trọng lực) vào một thiết bị chụp bên dưới mẫu . Điểm khác nhau của điểm trên là, tia laze ở đây chuyển động để cắt mô bằng cách di chuyển gương lưỡng sắc.
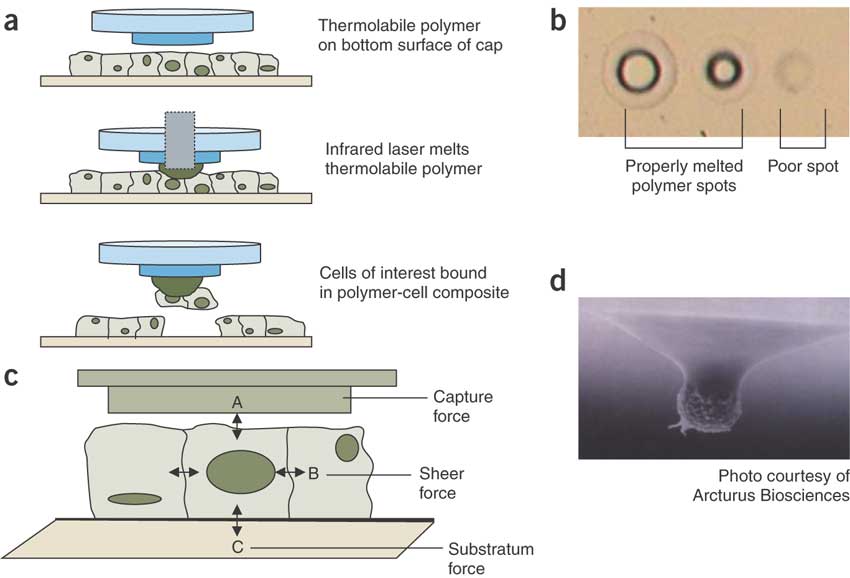
Khi các tế bào (trên một slide hoặc một loại văn hoá đặc biệt) được lựa chọn nằm ở trung tâm của lĩnh vực xem, toán tử sẽ chọn các tế bào quan tâm sử dụng phần mềm nhạc cụ. Khu vực sẽ được cô lập khi một laser IR gần để kích hoạt bộ phim truyền tải trên nắp được đặt trên mẫu mô, tan chảy chất kết dính sau đó kết hợp phim với các tế bào bên dưới của sự lựa chọn (xem Arcturus hệ thống); và / hoặc bằng cách kích hoạt một tia cực tím để cắt ra các tế bào quan tâm. Các tế bào sau đó được lấy ra khỏi phần mô mỏng, để lại tất cả các tế bào không mong muốn phía sau. Các tế bào quan tâm sau đó được xem và ghi lại trước khi khai thác.
Công nghệ dựa trên tia UV thứ tư (được sử dụng bởi Molecular Machines and Industries AG) tạo ra một sự khác biệt nhỏ với công nghệ thứ 3 ở đây bằng cách tạo ra một bánh sandwich các loại với slide> mẫu> và màng phủ lên mẫu bằng cách sử dụng một khung trượt có bề mặt màng được cắt bởi laser và cuối cùng được nhặt lên từ phía trên bằng một nắp keo đặc biệt.
Một công nghệ dựa trên tia UV thứ năm sử dụng các tấm kính thủy tinh tiêu chuẩn phủ một lớp phủ truyền tải trơ và một hệ thống vi phân tán bằng tia cực tím (thường là máy Leica LMD hoặc PALM Zeiss). Các mô của mô được gắn trên lớp phủ truyền năng lượng. Năng lượng từ tia UV được chuyển thành năng lượng động học khi va đập lớp phủ, làm bay hơi nó, đẩy nhanh các tính năng mô được chọn vào ống thu. Các tấm phủ truyền năng lượng, được thương mại hoá dưới tên thương mại DIRECTOR do Expression Pathology Inc. (Rockville, MD), cung cấp nhiều ưu điểm cho công việc của proteomic. Chúng cũng không tự động phát huỳnh quang, vì vậy chúng có thể được sử dụng cho các ứng dụng sử dụng các vết bẩn huỳnh quang, DIC hoặc ánh sáng phân cực
Ngoài các phần mô, LCM có thể được thực hiện trên các tế bào / sinh vật sống, tế bào ô nhiễm, các chế phẩm nhiễm sắc thể và mô thực vật.
Các ứng dụng
Quá trình phân tích microdissection laze không làm thay đổi hoặc phá huỷ hình thái học và hóa học của mẫu được thu thập, cũng như các tế bào xung quanh. Vì lý do này, LCM là một phương pháp hữu ích để thu thập các tế bào được chọn để phân tích ADN, RNA và / hoặc Protein. LCM cũng đã được sử dụng để cô lập cấu trúc tế bào, chẳng hạn như mảng bám amyloid. LCM có thể được thực hiện trên nhiều mẫu mô khác nhau bao gồm các vết bẩn máu, các chế phẩm cytologic, [14] tế bào nuôi cấy và các mẫu mô cứng. Có thể sử dụng các mô lưu trữ đông lạnh và parafin nhúng