Phép điện phân axit nucleic là một kỹ thuật phân tích được sử dụng để phân tách các đoạn ADN hoặc RNA theo kích thước và độ phản ứng. Các phân tử axit nucleic được phân tích dựa trên môi trường nhớt, gel, nơi mà một điện trường tạo ra các axit nucleic (được tích điện âm bởi đường xương phosphate) di chuyển đến cực dương (được tích điện dương bởi vì đây là một điện phân hơn là tế bào mạ). Sự phân chia các mảnh vỡ này được thực hiện bằng cách khai thác các tế bào di chuyển mà các phân tử có kích thước khác nhau có thể đi qua gel. Các phân tử dài hơn di chuyển chậm hơn bởi vì chúng gặp nhiều sự đề kháng trong gel. Bởi vì kích thước của phân tử ảnh hưởng đến sự di động của nó, các mảnh nhỏ hơn kết thúc gần cực dương hơn những hạt dài hơn trong một khoảng thời gian nhất định. Sau một thời gian, điện áp được loại bỏ và phân mảnh gradient được phân tích. Đối với sự phân cách lớn hơn giữa các mảnh có kích thước tương tự, điện áp hoặc thời gian chạy có thể tăng lên. Mở rộng chạy trên một gel điện áp thấp mang lại độ phân giải chính xác nhất. Tuy nhiên điện áp không phải là yếu tố duy nhất trong việc xác định điện di của axit nucleic.

Axit nucleic được tách ra có thể được điều chế bằng nhiều cách trước khi tách bằng điện di. Trong trường hợp các phân tử ADN lớn, DNA thường được cắt thành các đoạn nhỏ hơn sử dụng endonuclease hạn chế DNA (hoặc enzyme hạn chế). Trong các trường hợp khác, chẳng hạn như các mẫu khuếch đại PCR, các enzyme có trong mẫu có thể ảnh hưởng đến sự phân tách của các phân tử được loại bỏ bằng các phương tiện khác nhau trước khi phân tích. Khi axit nucleic đã được chuẩn bị đúng cách, các mẫu của dung dịch axit nucleic được đặt trong các giếng gel và điện áp được áp dụng trên gel trong một khoảng thời gian cụ thể.

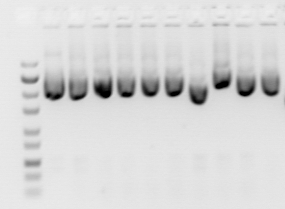
Các đoạn DNA có độ dài khác nhau được quan sát bằng một chất nhuộm huỳnh quang đặc trưng cho DNA, chẳng hạn như ethidium bromide. Gel hiển thị các dải tương ứng với các phân tử phân tử axit nucleic khác nhau với mật độ phân tử khác nhau. Kích cỡ mảnh vỡ thường được báo cáo trong “nucleotides”, “base par” hoặc “kb” (cho hàng nghìn cặp base) tùy thuộc vào việc axit nucleic đơn hoặc đôi có được tách ra. Xác định kích thước mảnh thường được thực hiện bằng cách so sánh với các marker DNA thương mại có chứa các đoạn DNA tuyến tính có chiều dài xác định.

Các loại gel được sử dụng phổ biến nhất cho điện di axit nucleic là agarose (đối với các phân tử ADN tương đối dài) và polyacrylamide (cho độ phân giải cao các phân tử ADN ngắn, ví dụ trong trình tự DNA). Gel thường được vận hành ở dạng “tấm” như thể hiện trong hình, nhưng điện di mao mạch trở nên quan trọng đối với các ứng dụng như trình tự DNA cao. Các kỹ thuật điện di được sử dụng để đánh giá các tổn thương DNA bao gồm điện di gel kiềm và điện di gel xung trường.

Đối với các phân đoạn ADN ngắn như ADN kép có từ 20 đến 60 bp, chạy chúng trong gel Polyacrylamide (PAGE) sẽ cho độ phân giải tốt hơn (điều kiện bản địa). Tương tự, RNA và ADN đơn lẻ có thể được chạy và hình dung bằng các loại gel PAGE có chứa các tác nhân gây ô nhiễm như Urê. PAGE được sử dụng rộng rãi trong các kỹ thuật như in chân DNA, EMSA và kỹ thuật tương tác DNA-protein khác.
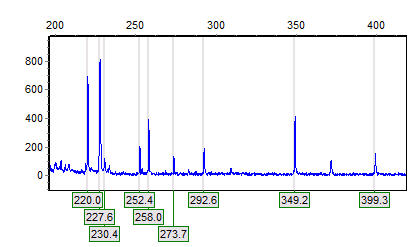
Việc đo đạc và phân tích phần lớn được thực hiện bằng một phần mềm phân tích gel chuyên dụng. Kết quả điện di mao mạch thường được hiển thị trong một lần xem vết gọi là chụp quang điện.

Các yếu tố ảnh hưởng đến di cư của axit nucleic
Một số yếu tố có thể ảnh hưởng đến sự di chuyển của axit nucleic: kích thước của lỗ gel, điện áp được sử dụng, cường độ ion của đệm, và thuốc nhuộm hoạt tính tập trung như ethidium bromua nếu được sử dụng trong quá trình điện di.
Kích thước của DNA
Gel sàng ADN theo kích thước của phân tử DNA, theo đó các phân tử nhỏ đi nhanh hơn. ADN kép có thể di chuyển với tốc độ xấp xỉ tỷ lệ nghịch với logarit của số cặp base. Mối quan hệ này phân hủy với các đoạn DNA rất lớn và không thể tách chúng bằng cách sử dụng điện di gel agarose chuẩn. Giới hạn độ phân giải phụ thuộc vào thành phần gel và cường độ trường. và sự di chuyển của ADN tròn lớn có thể bị ảnh hưởng mạnh hơn DNA tuyến tính do kích thước lỗ của gel. [4] Sự phân tách các đoạn ADN rất lớn đòi hỏi điện di gel trên xung trường (PFGE). Trong điện di gel đảo ngược trường (FIGE, một loại PFGE), có thể có “sự đảo ngược ban nhạc” – nơi các phân tử lớn có thể di chuyển nhanh hơn các phân tử nhỏ.
Gel của các chế phẩm plasmid thường cho thấy một dải lớn của DNA siêu trùm với các dải khác mờ hơn trong cùng một làn đường. Lưu ý rằng theo quy ước gel DNA được hiển thị với các đoạn DNA nhỏ gần dưới cùng của gel. Điều này là do lịch sử DNA gel được chạy theo chiều dọc và các đoạn ADN nhỏ hơn di chuyển xuống nhanh hơn.
Sự phù hợp của DNA
Sự cấu tạo của phân tử ADN có thể ảnh hưởng đáng kể đến chuyển động của ADN, ví dụ DNA siêu tráng thường di chuyển nhanh hơn DNA nới lỏng bởi vì nó bị co lại chặt chẽ và do đó nhỏ hơn. Trong quá trình chuẩn bị DNA plasmid bình thường, có thể có nhiều dạng DNA, và gel từ quá trình điện di của plasmid thường sẽ cho thấy một dải chính có thể là dạng phủ siêu âm, trong khi các dạng DNA khác có thể xuất hiện dưới dạng nhạt hơn ban nhạc. Các dải nhỏ này có thể bị nứt ADN (hình tròn mở) và hình dạng vòng tròn thư giãn thoải mái chạy chậm hơn ADN siêu đúc, và dạng đơn sợi (đôi khi có thể xuất hiện tùy theo phương pháp chuẩn bị) có thể di chuyển trước DNA siêu trùm . Tuy nhiên tốc độ di chuyển của các dạng khác nhau có thể thay đổi bằng cách sử dụng các điều kiện điện di động khác nhau, ví dụ DNA tuyến tính có thể chạy nhanh hơn hoặc chậm hơn ADN siêu trôi phụ thuộc vào điều kiện, và sự di chuyển của ADN tròn lớn hơn có thể ảnh hưởng mạnh hơn so với DNA tuyến tính bởi kích thước lỗ chân lông của gel. [4] Trừ khi các dấu hiệu DNA siêu lớp được sử dụng, kích thước của một ADN tròn như plasmid do đó có thể được đánh giá chính xác hơn sau khi nó đã được tuyến tính hoá bởi sự hạn chế tiêu hóa.
Tổn thất DNA do sự liên kết chéo tăng lên cũng sẽ làm giảm quá trình di chuyển DNA di chuyển theo liều phụ thuộc.