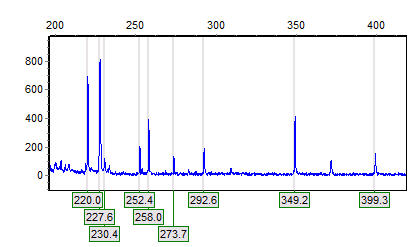
Nồng độ ethidium bromua
Thông tư DNA bị ảnh hưởng mạnh hơn bởi nồng độ ethidium bromide so với DNA tuyến tính nếu ethidium bromide có mặt trong gel trong quá trình điện di. Tất cả các vòng tròn DNA xảy ra tự nhiên đều nằm dưới đáy, nhưng ethidium bromide can thiệp vào ADN tròn có thể làm thay đổi điện tích, chiều dài, cũng như độ siêu dẫn của phân tử DNA, do đó sự hiện diện của nó trong quá trình điện di động có thể ảnh hưởng đến chuyển động của nó trong gel. Việc gia tăng ethidium bromua được can thiệp vào DNA có thể làm thay đổi nó từ một phân tử phủ siêu âm vào một dạng hoàn toàn thư giãn, sau đó là siêu xoắn tích cực ở mức độ tối đa. Agarose gel electrophoresis có thể được sử dụng để giải quyết DNA tròn với topo siêu ưu thế khác nhau.

Nồng độ gel
Nồng độ gel xác định kích thước lỗ của gel ảnh hưởng đến sự di chuyển của DNA. Độ phân giải DNA thay đổi với nồng độ phần trăm của gel. Tăng nồng độ agarose của gel làm giảm tốc độ di chuyển và cải thiện sự phân tách của các phân tử DNA nhỏ hơn, trong khi giảm nồng độ gel cho phép các phân tử ADN lớn được tách ra. Đối với điện di gel agarose chuẩn, 0,7% cho phép phân tách hoặc giải quyết tốt các mảnh ADN 5-10kb, trong khi 2% gel cho độ phân giải tốt cho các mảnh nhỏ 0.2-1kb. Có thể sử dụng tới 3% để tách các mảnh rất nhỏ nhưng một gel polyacrylamide đứng sẽ thích hợp hơn để xử lý các mảnh nhỏ. Nồng độ gel cao đòi hỏi thời gian chạy lâu hơn (đôi khi ngày) và tỷ lệ phần trăm cao gel thường giòn và có thể không đều. Cao agarose gel nên được chạy với PFGE hoặc FIGE. Thạch phần trăm thấp (0.1-0.2%) rất mong manh và có thể bị vỡ. 1% gel được phổ biến cho nhiều ứng dụng.

Trường ứng dụng
Ở điện áp thấp, tỷ lệ di chuyển của ADN là tỷ lệ với điện áp được áp dụng, tức là điện áp càng cao thì di chuyển DNA càng nhanh. Tuy nhiên, khi gia tăng cường độ điện trường, sự di động của các mảnh ADN có tỷ trọng phân tử tăng lên một cách khác biệt, và phạm vi tách giảm hiệu quả và giảm độ phân giải do đó thấp hơn ở điện áp cao. Để có độ phân giải tối ưu DNA> 2kb trong kích cỡ gel điện bình thường, nên dùng 5 đến 8 V / cm. Điện áp cũng bị hạn chế bởi thực tế là nó làm nóng gel và có thể làm cho gel tan chảy nếu một gel được chạy ở điện áp cao trong thời gian dài, đặc biệt đối với gel agarose điểm nóng chảy thấp.
Tuy nhiên, tính di động của DNA có thể thay đổi trong một trường không ổn định. Trong một lĩnh vực được đảo ngược theo định kỳ, tính di động của DNA có kích thước đặc biệt có thể giảm đáng kể ở một tần số đi xe đạp cụ thể Hiện tượng này có thể dẫn đến sự đảo ngược băng tần, nhờ đó các đoạn DNA lớn hơn di chuyển nhanh hơn các đoạn nhỏ hơn trong PFGE.
Cơ chế di chuyển và chia tách
Điện tích âm của xương phosphate của nó di chuyển DNA tới cực dương tích điện dương trong quá trình điện di. Tuy nhiên, di chuyển các phân tử DNA trong dung dịch, khi không có ma trận gel, độc lập với trọng lượng phân tử trong quá trình điện di, tức là không có sự phân chia theo kích thước mà không có ma trận gel . Sự tương tác thủy động học giữa các phần khác nhau của DNA bị cắt bỏ bằng cách truyền các phản ứng di chuyển theo hướng ngược lại, do đó không có cơ chế nào để tạo ra sự phụ thuộc của vận tốc trên chiều dài trên một quy mô lớn hơn chiều dài sàng lọc khoảng 10 nm. Điều này làm cho nó khác với các quá trình khác như lắng đọng hoặc khuếch tán khi tương tác thủy động lực kéo dài rất quan trọng.
Ma trận gel do đó có trách nhiệm tách DNA theo kích thước trong suốt quá trình điện di, tuy nhiên cơ chế chính xác chịu trách nhiệm về sự phân tách không hoàn toàn rõ ràng. Một mô hình tồn tại cho cơ chế tách các phân tử sinh học trong ma trận gel, một mô hình được Ogson chấp nhận rộng rãi trong đó xử lý ma trận polymer như một cái sàng bao gồm mạng lưới phân bố ngẫu nhiên các lỗ nối liền nhau Một protein hình cầu hoặc một ADN cuộn cảm ngẫu nhiên di chuyển qua các lỗ nối đủ lớn để có thể đi qua, và sự chuyển động của các phân tử lớn hơn có thể bị cản trở và làm chậm lại do va chạm với ma trận gel, và các phân tử có kích cỡ khác nhau có thể do đó được tách ra trong quá trình sàng này
Mô hình Ogston phân chia cho các phân tử lớn nhờ đó các lỗ nhỏ hơn đáng kể so với kích thước của phân tử. Đối với các phân tử DNA có kích thước lớn hơn 1 kb, một mô hình reptation (hoặc các biến thể của nó) được sử dụng phổ biến nhất. Mô hình này giả định rằng DNA có thể thu thập dữ liệu theo kiểu “giống rắn” (vì thế “ăn năn”) thông qua các lỗ chân lông như một phân tử dài. Ở cường độ điện trường cao hơn, điều này trở thành mô hình reptation thiên vị, theo đó đầu cuối của phân tử trở nên mạnh mẽ theo hướng về phía trước, và cạnh này dẫn đầu kéo phần còn lại của phân tử dọc theo. Trong chế độ biased hoàn toàn, sự di động đạt đến một điểm bão hòa và DNA vượt quá một kích thước nhất định không thể tách rời . Sự phối hợp song song hoàn hảo của dây chuyền với cánh đồng tuy nhiên không được quan sát thấy trong thực tế vì điều này có nghĩa là sự di chuyển của các phân tử dài và ngắn cũng giống nhau. Sàng sàng hơn nữa mô hình reptation thiên vị có tính đến các biến động nội bộ của chuỗi.
Mô hình reptation thiên vị cũng đã được sử dụng để giải thích tính di động của DNA trong PFGE. Định hướng của DNA dần dần được xây dựng bằng cách reptation sau khi bắt đầu một trường, và thời gian nó đạt đến vận tốc trạng thái ổn định phụ thuộc vào kích thước của phân tử. Khi trường thay đổi, các phân tử lớn hơn cần nhiều thời gian hơn để định hướng lại, do đó có thể phân biệt giữa các chuỗi dài mà không thể đạt được vận tốc trạng thái ổn định từ những đoạn ngắn đi qua hầu hết thời gian với vận tốc ổn định Các mô hình khác, tuy nhiên, cũng tồn tại.

Các kính hiển vi huỳnh quang thời gian thực của các phân tử đã nhuộm cho thấy sự năng động tinh tế hơn trong quá trình điện di, với DNA thể hiện tính đàn hồi đáng kể khi nó luân phiên trải dài theo hướng của trường ứng dụng và sau đó co lại thành một quả bóng, hoặc bị móc nối thành hình chữ U khi nó được bị bắt trên các sợi polymer Quan sát này có thể được gọi là mô hình “sâu bướm”. Mô hình khác gợi ý rằng ADN bị vướng vào ma trận polymer, và càng lớn phân tử thì càng trở nên vướng víu và phong trào của nó bị cản trở