Điện di gel hai chiều, viết tắt là điện di 2-DE hoặc điện di 2-D, là một dạng điện di gel thường được sử dụng để phân tích các protein. Hỗn hợp của protein được tách ra bằng hai tính chất trong hai chiều trên gel 2D. 2-DE lần đầu tiên được độc lập bởi O’Farrell và Klose vào năm 1975.
Cơ sở để tách
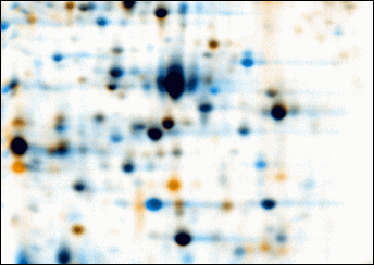
Phép điện di 2-D bắt đầu bằng điện di ở kích thước đầu tiên và sau đó phân tách các phân tử vuông góc từ phần đầu tiên để tạo ra một điện bầu dục trong chiều thứ hai. Trong quá trình điện di ở kích thước đầu tiên, các phân tử được tách tuyến tính theo điểm đẳng điện của chúng. Trong kích thước thứ hai, các phân tử sau đó được tách ra ở 90 độ từ lần phóng điện đầu tiên theo khối lượng phân tử. Do không có khả năng hai phân tử tương tự nhau ở hai tính chất riêng biệt, các phân tử được tách biệt hiệu quả hơn trong điện di 2-D so với điện di 1-D.
Hai yếu tố mà protein được tách ra thành sử dụng kỹ thuật này có thể là điểm đẳng điện, khối lượng phức tạp của protein ở trạng thái bản địa và khối lượng protein.

Tách các protein bằng điểm đẳng điện được gọi là tập trung tập trung (IEF). Do đó, một gradient độ pH được áp dụng cho một gel và một điện tiềm năng được áp dụng trên gel, làm cho một kết thúc tích cực hơn khác. Ở tất cả các giá trị pH khác với điểm đẳng điện, protein sẽ được nạp. Nếu chúng được tích điện dương, chúng sẽ bị kéo về phía cuối tiêu cực của gel và nếu chúng bị tích điện âm, chúng sẽ được kéo đến đầu cực dương của gel. Các protein được áp dụng trong kích thước đầu tiên sẽ di chuyển dọc theo gel và sẽ tích tụ tại điểm đẳng điện của chúng; đó là, điểm mà tại đó tổng số phí trên protein là 0 (một tính trung tính).

Để phân tích chức năng của protein trong tế bào, kiến thức về sự hợp tác của chúng là rất cần thiết. Hầu hết các protein hoạt động cùng nhau trong các phức hợp để có chức năng đầy đủ. Việc phân tích tổ chức cơ quan con của tế bào này đòi hỏi các kỹ thuật bảo tồn trạng thái bản địa của phức hợp protein. Trong điện di gel polyacrylamide tự nhiên (bản gốc PAGE), các protein vẫn ở trạng thái tự nhiên và được tách ra trong điện trường theo khối lượng và khối lượng phức của chúng. Để có được sự tách biệt theo kích cỡ và không phải bằng phí ròng, như trong IEF, một khoản phí bổ sung được chuyển tới các protein bằng cách sử dụng Coomassie Brilliant Blue hoặc lysium dodecyl sulfate. Sau khi hoàn thành kích thước đầu tiên, các phức hợp sẽ bị phá hủy bằng cách áp dụng SDS-PAGE gây ô nhiễm ở kích thước thứ hai, trong đó các protein của phức hợp được tạo thành bằng cách tách khối lượng của chúng.

Trước khi phân tách các protein theo khối lượng, chúng được xử lý với natri dodecyl sulfat (SDS) cùng với các thuốc thử khác (SDS-PAGE trong 1-D). Điều này làm mờ các protein (tức là nó giải phóng chúng thành các phân tử dài, thẳng) và gắn một số phân tử SDS tỉ lệ với chiều dài của protein. Bởi vì chiều dài của protein (khi mở ra) tương đương với khối lượng của nó, điều này tương đương với việc nói rằng nó gắn một số phân tử SDS tỉ lệ với khối lượng của protein. Vì các phân tử SDS bị tích điện âm, kết quả của điều này là tất cả các protein sẽ có cùng một tỷ lệ so với khối lượng so với nhau. Ngoài ra, các protein sẽ không di chuyển khi không có điện tích (kết quả của bước tập trung đẳng điện) do đó lớp vỏ của protein trong SDS (tích điện âm) cho phép di chuyển các protein trong kích thước thứ hai (SDS-PAGE, không phải là tương thích để sử dụng trong kích thước đầu tiên vì nó được tính và sử dụng một chất tẩy không ion hoặc ion lơ lửng). Trong kích thước thứ hai, điện thế lại được áp dụng, nhưng ở góc 90 độ so với trường đầu tiên. Các protein sẽ bị thu hút bởi mặt tích cực hơn của gel (vì SDS được tích điện âm) tương ứng với tỷ lệ khối lượng của chúng-to-charge. Như đã giải thích trước đây, tỷ lệ này sẽ gần như giống nhau đối với tất cả các protein. Sự tiến bộ của các protein sẽ bị chậm lại bởi lực ma sát. Vì vậy gel hoạt động như một giọt phân tử khi áp dụng, tách các protein trên cơ sở trọng lượng phân tử của chúng với các protein lớn hơn được giữ lại trong gel và các protein nhỏ hơn có thể đi qua sàng và tiếp cận các vùng dưới của gel .