(TRFLP hoặc đôi khi T-RFLP) là một kỹ thuật sinh học phân tử để định hình các cộng đồng vi sinh dựa trên vị trí của một vị trí hạn chế gần nhất với một kết thúc nhãn của một gen khuếch đại. Phương pháp này dựa trên việc tiêu hóa một hỗn hợp của các biến thể khuếch đại PCR của một gen đơn sử dụng một hoặc nhiều enzyme hạn chế và phát hiện kích cỡ của mỗi mảnh kết cục cuối cùng bằng cách sử dụng một trình tự DNA. Kết quả là một hình ảnh đồ thị, trong đó trục x đại diện cho các kích thước của đoạn và trục y biểu diễn cường độ huỳnh quang của chúng.
Bối cảnh
TRFLP là một trong một số phương pháp phân tử nhằm tạo ra dấu vân tay của một cộng đồng vi khuẩn không rõ. Các phương pháp tương tự khác bao gồm DGGE, TGGE, ARISA, ARDRA, PLFA, v.v.
Các phương pháp thông lượng tương đối cao đã được phát triển để giảm chi phí và nỗ lực trong việc phân tích các cộng đồng vi sinh bằng cách sử dụng một thư viện nhân bản. Phương pháp này được Liu và các đồng nghiệp mô tả lần đầu tiên vào năm 1997 sử dụng khuếch đại gen mục tiêu 16S rDNA từ DNA của một số vi khuẩn bị cô lập cũng như các mẫu môi trường.
Kể từ đó, phương pháp đã được áp dụng cho việc sử dụng các gen marker khác như gen marker chức năng pmoA để phân tích các cộng đồng methanotrophic.
Phương pháp
Giống như hầu hết các phương pháp phân tích cộng đồng khác, TRFLP cũng dựa trên sự khuếch đại PCR của một gen mục tiêu. Trong trường hợp TRFLP, khuyếch đại được thực hiện với một hoặc cả hai mồi có đầu 5 ‘được gắn nhãn với một phân tử huỳnh quang. Trong trường hợp cả hai mồi được dán nhãn, nhuộm huỳnh quang khác nhau là cần thiết. Mặc dù một số thuốc nhuộm huỳnh quang thông thường có thể được sử dụng cho mục đích gắn nhãn như 6-carboxyfluorescein (6-FAM), ROX, carboxytetramethylrhodamine (TAMRA, thuốc nhuộm gốc rhodamin) và hexachlorofluorescein (HEX), thuốc nhuộm được sử dụng rộng rãi nhất là 6 -FAM. Hỗn hợp của amplicon sau đó sẽ phải chịu một phản ứng hạn chế, thông thường sử dụng một enzyme hạn chế bốn lưỡi cắt. Sau phản ứng hạn chế, hỗn hợp của các mảnh được tách ra bằng cách sử dụng điện di mao mạch hoặc polyacrylamide trong một trình tự DNA và các kích cỡ của các đầu cuối khác nhau được xác định bởi máy dò huỳnh quang. Bởi vì hỗn hợp được chiết trộn của amplicon được phân tích trong một trình tự tuần tự, chỉ các đoạn đầu cuối (tức là đầu hoặc cuối của nhãn amplion) được đọc trong khi tất cả các đoạn khác bị bỏ qua. Như vậy, T-RFLP khác với ARDRA và RFLP, trong đó các mảnh hạn chế được hình dung. Ngoài các bước này, giao thức TRFLP thường bao gồm việc dọn sạch các sản phẩm PCR trước khi hạn chế và trong trường hợp điện di mao mạch được sử dụng trong giai đoạn khử muối cũng được thực hiện trước khi chạy mẫu.
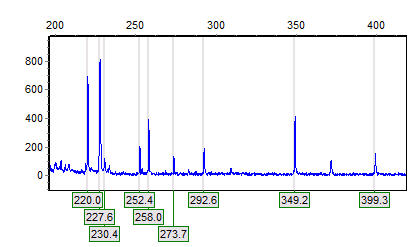
Định dạng dữ liệu và hiện vật
Kết quả của một T-RFLP profiling là một đồ thị được gọi là electropherogram mà là một biểu đồ cường độ âm mưu của một thử nghiệm điện di (gel hoặc mao mạch). Trong một bài kiểm tra điện, trục X đánh dấu kích thước của các mảnh, trong khi trục Y đánh dấu mức độ huỳnh quang của mỗi đoạn. Do đó, những gì xuất hiện trên một gel điện di như một ban nhạc xuất hiện như là một đỉnh cao của electropheogram mà tách rời của nó là tổng số huỳnh quang của nó. Trong một cấu hình T-RFLP, mỗi đỉnh giả định tương ứng với một biến thể di truyền trong mẫu ban đầu trong khi chiều cao hoặc diện tích tương ứng với sự phong phú tương đối của nó trong cộng đồng cụ thể. Cả hai giả định nêu trên, tuy nhiên, không phải lúc nào cũng được đáp ứng. Thông thường, một số vi khuẩn khác nhau trong một quần thể có thể đưa ra một đỉnh duy nhất trên đồ điện cổ do có vị trí hạn chế cho các enzyme hạn chế được sử dụng trong thí nghiệm ở cùng vị trí. Để khắc phục vấn đề này và tăng cường khả năng giải quyết của kỹ thuật này, một mẫu đơn có thể được tiêu hóa bằng một số enzyme (thường là ba) dẫn đến ba cấu hình T-RFLP trên một mẫu mỗi giải quyết một số biến thể trong khi thiếu các loại khác. Một sửa đổi đôi khi được sử dụng cũng là để ghi nhãn huỳnh quang bằng sơn lót ngược lại bằng cách sử dụng một chất nhuộm khác, và kết quả là hai cấu hình song song trên mỗi mẫu sẽ giải quyết một số lượng biến thể khác nhau.
Ngoài sự hội tụ của hai biến thể di truyền khác biệt vào một hiện vật đỉnh duy nhất cũng có thể xuất hiện, chủ yếu ở dạng đỉnh núi giả. Các đỉnh núi giả thường có hai loại: các “TRADE” nền “tiếng ồn” và “giả”. Đỉnh nền (tiếng ồn) là đỉnh điểm do độ nhạy của máy dò đang được sử dụng. Những đỉnh này thường có cường độ thấp và thường gây ra vấn đề trong trường hợp tổng cường độ hồ sơ thấp (nghĩa là nồng độ DNA thấp). Bởi vì những đỉnh này là kết quả của tiếng ồn nền, chúng thường không thể tái tạo được cấu trúc nên vấn đề có thể được giải quyết bằng cách tạo ra một sự đồng thuận từ nhiều bản sao hoặc bằng cách loại bỏ các đỉnh dưới một ngưỡng nhất định. Một số kỹ thuật tính toán khác cũng đã được giới thiệu để giải quyết vấn đề này . Mặt khác, Pseudo TRF là những đỉnh núi có khả năng tái tạo và tuyến tính với lượng DNA được nạp. Những đỉnh này được cho là kết quả của việc ssDNA tự ủ lên và tạo ra các vị trí hạn chế sự thụ thể ngẫu nhiên có sợi đôi sau đó được công nhận bởi enzyme hạn chế dẫn đến một đoạn cuối mà không đại diện cho bất kỳ biến thể di truyền chính hãng nào. Người ta đã gợi ý rằng việc áp dụng một exonuclease DNA như exonuclease đậu Mung trước giai đoạn tiêu hóa có thể loại bỏ hiện vật đó.