Tiêu chuẩn axit-bazơ
Hình 8. Phản ứng NaOH với HCl 1 mol / l
Xác định các axit và bazan hoàn toàn không liên kết
Nhiệt neutralizing của một axit hoàn toàn liên kết với một cơ sở hoàn toàn tách ra khoảng -56kJ / mol. Phản ứng như vậy là rất tỏa nhiệt, và là một cơ sở tuyệt vời cho một loạt các phân tích trong ngành công nghiệp. Một thuận lợi cho nhà phân tích công nghiệp là việc sử dụng các mức chuẩn mạnh hơn (1 đến 2 mol / L) cho phép giảm lượng mẫu chuẩn bị, và các mẫu có thể được phân phối trực tiếp và chính xác vào bình chuẩn độ trước khi chuẩn độ.

Hình 9. Phản ứng của bicacbonat trong công ty với cacbonat bằng 1 mol / l NaOH
Sự chuẩn độ của axit yếu
Các axit không liên kết yếu tạo ra những điểm kết cuối nhiệt độ cao khi được chuẩn độ với một bazơ mạnh. Ví dụ, bicarbonate có thể được xác định rõ ràng trong công ty cacbonat bằng cách khử nitơ bằng hydroxyl (Δ0Hr = -40.9 kJ / mol).
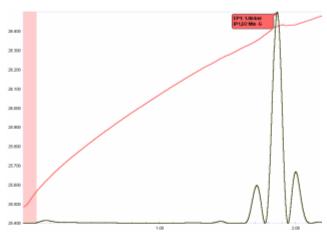
Hình 10. ĐỊNH LƯỢNG hỗn hợp axit nitric, acetic và phosphoric với 2 mol / L NaOH
Chuẩn độ axit hỗn hợp
Hỗn hợp của axit phức có thể được giải quyết bằng phép chuẩn độ nhiệt với NaOH tiêu chuẩn trong dung dịch nước. Trong một hỗn hợp các axit nitric, acetic và phosphoric được sử dụng trong quá trình chế tạo chất bán dẫn, có thể dự đoán được ba điểm cuối trên cơ sở các hằng số phân ly của axit:
| Endpoint 1 | Endpoint 2 | Endpoint 3 |
|---|---|---|
| HNO3(pKa = -1.3) | HOAc(pKa = 4.75) | |
| H3PO4(pKa1 = 2.12) | H3PO4(pKa2 = 7.21) | H3PO4(pKa3 = 12.36) |
Chìa khóa để xác định lượng axit có trong hỗn hợp là khả năng để có được một giá trị chính xác cho lượng axit photphoric hiện diện, như được phát hiện bằng việc chuẩn độ proton thứ ba của H3PO4.

Hình 10 minh hoạ sơ đồ chuẩn độ của hỗn hợp này, cho thấy 3 điểm cuối sắc nét.

Hình 11. Phép tích chuẩn để xác định “tổng caustic”, “total soda” và “alumina” trong rượu nhôm oxit.
Chuẩn độ các dung dịch kiềm phức tạp
Phân tích độ chuẩn độ nhiệt của dung dịch sodium aluminate (“rượu Bayer”) trong sản xuất alumina từ bô xít được thực hiện trong chuỗi tự động chuẩn độ hai lần. Đây là một sự thích ứng của một ứng dụng chuẩn độ nhiệt độ cổ điển (VanDalen and Ward, 1973). Trong lần chuẩn độ đầu tiên, dung dịch tartrate được thêm vào một lượng rượu lên aluminat phức tạp, giải phóng một mol hydroxyl cho mỗi mol aluminat hiện tại. Điều này được định chuẩn acidimetrically cùng với hydroxyl “miễn phí” và hàm lượng cacbonat (như là một điểm cuối thứ hai). Việc chuẩn độ thứ hai được thực hiện bằng việc bổ sung tự nhiên dung dịch florua. Phức hợp alumina-tartrat bị phá vỡ trong lợi của sự hình thành một phức hợp nhôm fluoride và đồng thời phát hành ba mol của hydroxyl cho mỗi mol của nhôm hiện tại, sau đó được định lượng acidimetrically. Toàn bộ quyết tâm có thể hoàn thành trong vòng chưa đến 5 phút.

Hình 12. Xác định H2SO4 tự do trong dung dịch ướp đồng bằng phương pháp chuẩn độ trong propan-2-ol với 1 mol / L KOH trong propan-2-ol
Tiêu chuẩn axit không dung dịch nước
Các chuẩn độ axit bazơ không dung dịch có thể được thực hiện thuận lợi bằng các phương pháp nhiệt kế.
Các giải pháp lọc axit từ một số mỏ đồng có thể chứa một lượng lớn Fe (III) cũng như Cu (II). Hàm lượng acid “tự do” (sulfuric acid) trong các dung dịch ướp này là một thông số quy trình quan trọng. Trong khi các phép đo nhiệt độ có thể xác định hàm lượng axit tự do với số lượng khiêm tốn Fe (III), trong một số dung dịch hàm lượng Fe (III) cao đến mức gây nhiễu nghiêm trọng. Complexation với nhất thiết phải là một lượng lớn oxalat là không mong muốn do độc tính của thuốc thử. Một phép chuẩn độ nhiệt được tạo ra bằng cách pha loãng mẫu với propan-2-ol và chuẩn độ với KOH chuẩn trong propan-2-ol. Hầu hết các chất kim loại kết tủa trước khi bắt đầu chuẩn độ, và một kết thúc rõ ràng, sắc nét cho hàm lượng axit sulfuric đã được thu được